|
Рефератыполиграфия и этнографии москвоведению и спорту языку |
Реферат: Коллоидные системы в организме и их функцииРеферат: Коллоидные системы в организме и их функцииМосковский Государственный Университет имени М.В. Ломоносова Факультет фундаментальной медицины Курс общей и неорганической химии Реферат по общей и неорганической химии: Коллоидные системы в организме и их функции ИСПОЛНИТЕЛЬ: студ. I курса Селявко Юрий Александрович ПРЕПОДАВАТЕЛЬ: к.х.н., доц. Захаров Максим Александрович Москва 2004г. Содержание Глава 1. Коллоидные системы. Общие сведения............................................... 3 1.1 Понятие коллоидной системы. Коллоидная химия..................................... 3 1.2 Развитие представлений о коллоидных системах и их свойствах.............. 5 1.3 Типы и свойства коллоидных систем. Лиофобные золи. Лиофильные коллоиды. Области практического приминения коллоидов............................................... 8 Глава 2 Организм человека как единая коллоидная система. Биологическая роль основных коллоидных систем организма........................................................ 26 2.1 Коллоидно-химическая физиология человека........................................... 26 2.2 Коллоидная система клеток и тканей организма....................................... 27 2.3. Ткани организма как коллоидные системы.............................................. 28 Глава 3 Коллоиды как лекарственные средства.............................................. 35 Заключение........................................................................................................ 45 Библиография................................................................................................... 50 Глава 1. Коллоидные системы. Общие сведения 1.1. Понятие коллоидной системы. Коллоидная химия.Коллоидные дисперсные системы (дисперсии) – микрогетерогенные образования, в которых одно мелкораздробленное вещество – дисперсная фаза – равномерно распределено (диспергировано) в другой фазе – дисперсионной среде. В коллоидных системах размер частиц дисперсной фазы составляет 10–9–10–7 м, т.е. лежит в интервале от нанометров до долей микрометров. Эта область превосходит размер типичной малой молекулы, но меньше размера объекта, видимого в обычном оптическом микроскопе. Коллоидная химия (далее К.х.) - раздел физической химии, занимающийся изучением коллоидных систем и их поверхностных явлений. К. х. как самостоятельная наука возникла в 60-е годы 19 в. С тех пор её предмет и методы существенно изменились. В период становления К. х. «коллоидами» называли клееподобные аморфные тела (в отличие от кристаллических тел, «кристаллоидов»); теперь термин «коллоиды» — синоним высокодисперсных (микрогетерогенных) систем, то есть дисперсных систем с наиболее развитой поверхностью раздела фаз. К. х. изучает своеобразные процессы и явления, обусловленные особенностями высокодисперсного состояния тел. К ним относятся, например, самопроизвольное укрупнение частиц твёрдой дисперсной фазы или капель жидкости (коагуляция и коалесценция) как проявление термодинамической (агрегативной) неустойчивости дисперсных систем; застудневание жидких дисперсных систем с образованием гелей и возникновение пространственных дисперсных структур; взаимодействие соприкасающихся тел (трение, адгезия) и изменение этого взаимодействия под влиянием веществ, адсорбирующихся на поверхностях соприкосновения; явления в тонких жидких и твёрдых плёнках; самопроизвольное диспергирование жидкостей и твёрдых тел. Характерные особенности объектов изучения К. х. обусловили развитие специфических методов исследования, таких как ультрацентрифугирование, ультрафильтрация, диализ и электродиализ, электроосмос и электрофорез, различные методы фракционирования и дисперсионного анализа, ультрамикроскопия, электронная микроскопия, нефелометрия и т.д. Современная К. х. включает следующие основные разделы. 1) Молекулярно-кинетические явления (броуновское движение, диффузия) в дисперсных системах; гидродинамика дисперсных систем; дисперсионный анализ. 2) Поверхностные явления: адсорбция (термодинамика и кинетика), смачивание, адгезия, поверхностно-химические процессы в дисперсных системах; строение и свойства поверхностных (адсорбционных) слоев. 3) Теория возникновения новой (дисперсной) фазы в метастабильной (пересыщенной) среде; конденсационные методы образования дисперсных систем. 4) Теория устойчивости, коагуляция и стабилизация коллоидно-дисперсных систем; строение частиц дисперсной фазы (мицелл). 5) Физико-химическая механика дисперсных систем, включающая теорию механического диспергирования, явления адсорбционного понижения прочности твёрдых тел, реологию дисперсных систем; образование и механические свойства пространственных структур в дисперсных системах. 6) Электрические и электрокинетические явления в дисперсных системах. 7) Оптические явления в дисперсных системах (коллоидная оптика) — светорассеяние, светопоглощение; К. х. фотографических процессов. Вся природа — организмы животных и растений, гидросфера и атмосфера, земная кора и недра — представляет собой сложную совокупность множества разнообразных и разнотипных грубодисперсных и коллоидно-дисперсных систем. Дисперсное состояние вполне универсально и при соответствующих условиях в него может перейти любое тело. Этим определяется особое положение К. х., развитие которой осуществляется в непосредственном контакте и взаимодействии со многими, часто не связанными между собой областями науки, промышленности, медицины и сельского хозяйства. Развитие К. х. связано с актуальными проблемами различных областей естествознания и техники. К. х. разрабатывает научные основы технологических процессов с участием дисперсных систем. К ним относятся технология строительных материалов, силикатов (особенно керамики), технология пластмасс, резины, лакокрасочных материалов с использованием высокодисперсных пигментов и наполнителей; технология бурения горных пород, механической обработки твёрдых материалов, в том числе металлов; процессы гетерогенного катализа и адсорбционные процессы. Учение о дисперсных структурах лежит в основе науки о материалах будущего, без которой невозможен технический прогресс. К. х. указывает рациональные пути разрушения нефтяных эмульсий (деэмульгирование сырых нефтей — основной способ их обезвоживания и обессоливания); создания дисперсных — наиболее эффективных — форм пестицидных препаратов, широко применяемых в сельском хозяйстве; использования поверхностно-активных веществ в составе моющих и очищающих средств, эмульгаторов, флоторсагентов, присадок к смазочным маслам и т.д. Важнейшие проблемы геологии и геохимии (возникновение и превращения минералов и горных пород, выветривание), почвоведения, грунтоведения теснейшим образом связаны с законами поведения многокомпонентных и микрогетерогенных систем. Метеорология в изучении атмосферных осадков опирается на учение об аэродисперсных системах. Совместно с биохимией и физикохимией полимеров К. х. составляет основу учения о биологических структурах, о возникновении и развитии жизни.
1.2 Развитие представлений о коллоидных системах и их свойствах.Развитие представлений о коллоидных системах и их свойствах. Коллоидные процессы, такие, как крашение и склеивание, использовались еще в древнем Египте. Слово «коллоид» (от греческого слова, означающего «клей») было введено Т. Грэмом в 1862. Он установил различие между кристаллоидами (например, соль, сахар), которые после растворения в воде легко диффундируют через мембрану из пергамента, и коллоидами, такими, как желатин, которые не обладают такими свойствами. В 1857 М.Фарадей приготовил коллоидный раствор золя золота и показал, что сильный пучок (луч) света значительно рассеивается, проходя через эту дисперсию, таким образом, что его путь становится видимым – так же, как это происходит с лучом света в пыльной комнате или лучом от автомобильных фар туманным вечером. Это явление называется эффектом Тиндаля (в честь Дж. Тиндаля, который изучал его в 1869). Теория рассеяния света была разработана Дж.Рэлеем в 1871. Работа в этом направлении была продолжена Г.Маем и П.Дебаем в 1908 и 1909 соответственно. Эксперименты по рассеянию света являются одним из наиболее эффективных средств для изучения коллоидных частиц и макромолекул; компьютерное обеспечение позволило достичь значительного успеха в этих исследованиях. Так как размеры коллоидных частиц очень малы, их собственные направления движения изменяются непрерывно в результате случайных столкновений с молекулами дисперсионной среды. Каждая частица движется по зигзагообразной траектории. Это явление в 1827 впервые наблюдал Р.Броун в воде, в которой были суспендированы частицы цветочной пыльцы; оно было названо броуновским движением. В период 1902–1912 Р.Зигмонди создал ультрамикроскоп, который сделал возможной идентификацию коллоидных частиц по отраженному ими свету. Ультрамикроскоп позволял считать количество коллоидных частиц и изучать их движение. Основные положения теории броуновского движения и его макроскопического проявления – диффузии – были разработаны А.Эйнштейном в 1905 и экспериментально подтверждены в 1908 Ж.Перреном. В 1923 Т.Сведберг разработал ультрацентрифугу, которая позволила разделять коллоидные частицы и определять их массы. В химии поверхностных явлений И. Ленгмюр предположил в 1916 и позже доказал существование мономолекулярной адсорбции, т.е. прилипания к поверхности слоя вещества толщиной в одну молекулу. Это свойство особенно важно при изучении адсорбции газов и в гетерогенном катализе, но оно также имеет отношение и к границам раздела фаз в коллоидных системах. Обычно на границе раздела фаз существует разделение электрического заряда, связанное с ионной природой фаз и с неэквивалентной (специфической) адсорбцией ионов. Это приводит к возникновению двойного электрического слоя и электрокинетических явлений, таких, как электрофорез, электроосмос и потенциал течения (см. ниже). Электрофорез (движение заряженных частиц в электрическом поле) впервые наблюдал Ф.Ройс в 1809, который показал, что отрицательно заряженные частицы суспензии глины мигрируют в сторону положительного электрода. А.Тизелиус в 1937 применил электрофорез для анализа биополимеров, в частности методом электрофореза разделял сыворотку крови на пять белковых фракций. В 1910 Л.Гуи и Д.Чапмен развили простую (электростатическую) теорию двойного электрического слоя. Дальнейшим усовершенствованием этой теории занимались О.Штерн (1924) и Д.Грэм (1947) на основе более сложных моделей, которые значительно лучше согласовались с экспериментом, чем теория Гуи – Чапмена. В 1931 Г.Шульце и В.Харди изучили процесс коагуляции простых лиофобных золей при добавлении электролита и установили, что наиболее важным параметром в этом процессе является валентность противоиона. Было установлено, что в простейшем случае устойчивость коллоидной дисперсной системы зависит от баланса вандерваальсовых (слабые силы притяжения) и кулоновских (электростатическое отталкивательное взаимодействие двойных слоев) сил. В 1937 X.Хамейкер показал, каким образом можно рассчитать вандерваальсово притяжение между коллоидными частицами с помощью суммирования сил притяжения между всеми атомными парами системы. Б.В.Дерягиным и Л.Д.Ландау и независимо от них Э.Фервейем и Я.Овербеком в 1937 была разработана и в последующие годы усовершенствована теория устойчивости коллоидных систем. Лучшее понимание роли вандерваальсовых сил в коллоидных системах вытекает из макроскопического приближения, разработанного Е.М.Лифшицем в 1956. Современные экспериментальные методы позволяют измерить вандерваальсовы и электростатические взаимодействия двойных слоев. Важный вклад в изучение коллоидных систем организма человека внесли труды Л. Михаэлиса, Г.Шаде, В. Оствальда, Ф.Гофмейстера, Э. Абдергальдена, Г.Фрейндлиха и др. Отличительной чертой современной коллоидной химии является то, что она охватывает широкое поле деятельности, включая чрезвычайно изощренную (сложную) теорию, с одной стороны, и простые эмпирические наблюдения, с другой. 1.3 Типы и свойства коллоидных систем. Лиофобные золи. Лиофильные коллоиды. Области практического приминения коллоидов.Типы и свойства коллоидных систем. Физические свойства коллоидной дисперсной системы зависят от соответствующих свойств фаз, составляющих коллоидную систему. Например, эмульсия масла в воде (М/В) и эмульсия воды в масле (В/М) могут иметь почти одинаковый состав, однако их физико-химические свойства будут сильно различаться. Термин «золь» используется для отличения коллоидных суспензий от макроскопических; хотя четкое разграничение между ними отсутствует, размеры частиц золя в общем случае достаточно малы, что обеспечивает их свободное прохождение через фильтровальную бумагу. Если дисперсионной средой является вода, то используется термин «гидрозоль», а если дисперсная фаза имеет полимерную природу, дисперсная система называется латексом. Паста является золем или суспензией с высокой концентрацией дисперсной фазы. Свойства коллоидных дисперсий зависят также от природы границы раздела между дисперсионной фазой и дисперсной средой. Несмотря на большую величину отношения поверхности к объему, количество вещества, необходимого для модификации границы раздела в типичных дисперсных системах, очень мало; добавление малых количеств подходящих веществ (особенно поверхностно-активных (ПАВ), полимеров и поливалентных противоионов, см. ниже) может существенно изменить объемные свойства коллоидных дисперсных систем. Например, резко выраженное изменение консистенции (плотности, вязкости) суспензий глины может быть вызвано добавлением малых количеств ионов кальция (загущение, уплотнение) или фосфат-ионов (разжижение). Исходя из этого, химию поверхностных явлений можно рассматривать как составную часть коллоидной химии, хотя обратное соотношение вовсе не обязательно. В соответствии с составом и строением коллоидные дисперсии классифицируются следующим образом:
Термины лиофобный («боящийся жидкости») и лиофильный («любящий жидкость») используются для описания тенденции поверхности или функциональной группы к смачиванию или сольватации. Если жидкой дисперсионной средой является вода, используются термины гидрофобный и гидрофильный. Лиофобные дисперсные системы (например, дисперсии иодида серебра, кремнезема и полистирольного латекса) образуются в результате механической или химической обработки. В этих системах, однако, всегда существует некоторое (часто значительное) сродство между поверхностью диспергированных частиц и дисперсионной средой (иначе поверхность частицы не смачивалась бы и дисперсия бы не образовалась), так что частицы этих «лиофобных» дисперсий на самом деле имеют «лиофильные» поверхности. К «лиофильным» традиционно относят растворимые макромолекулы (хотя в них могут присутствовать «лиофобные» области, как в случае белков). Возможно, удобнее классифицировать коллоидные системы по термодинамическому принципу как обратимые и необратимые, в зависимости от того, могут или не могут они самопроизвольно образовываться при смешении их компонентов. Лиофобные золи термодинамически неустойчивы и их частицы с течением времени склонны к агрегации и осаждению. Образование таких золей происходит в результате дробления вещества в объеме раствора либо при агрегации небольших молекул или ионов. Диспергирование объемных материалов посредством механического измельчения, ультразвуковой обработки и других подобных методов обычно не приводит к получению частиц меньшего размера, чем верхний предел области коллоидных частиц. Более высокая степень диспергирования часто достигается применением метода агрегации, связанного с образованием молекулярно диспергированного пересыщенного раствора, из которого дисперсная фаза «осаждается» в нужной форме. Для этой цели могут быть использованы комбинированные методы, такие, как замена хорошего растворителя на менее хороший, охлаждение и различные химические реакции. Примеры химических реакций, с помощью которых получаются гидрозоли в соответствующих условиях эксперимента: кипячение раствора хлорида железа(III), в результате чего получаются частицы оксида железа(III) малого размера; реакция между разбавленными растворами тиосульфата натрия и соляной кислоты с образованием дисперсной серы; реакция между разбавленными растворами нитрата серебра и иодида калия с образованием малых частиц иодида серебра. Полимерные латексы можно получать методом эмульсионной полимеризации. Образование новой фазы в процессе «осаждения» включает образование зародышей (центров кристаллизации) и рост новой фазы; соотношение скоростей этих процессов и определяет размер частиц. Высокая степень дисперсности получается, если скорость зародышеобразования велика, а скорость роста частицы мала. Ингибиторы роста могут применяться не только для получения частиц малого размера, но также для селективного действия на рост отдельных граней кристалла, т.е. для изменения формы частицы. Это важно для приготовления катализаторов гетерогенного катализа, так как кристаллографическая ориентация граней влияет на эффективность катализатора. Если осаждаемый порошок обладает умеренной растворимостью, то состав дисперсной фазы меняется во времени (наблюдается явление старения), когда менее растворимые частицы большего размера растут за счет малых (но более растворимых) частиц. Большинство препаративных методов приводит к образованию полидисперсных золей (в которых частицы имеют распределение по размерам). Можно приготовить (например, с помощью методов зародышеобразования при условиях, которые приводят к спонтанной кристаллизации) почти монодисперсные золи, в которых размеры частиц примерно равны. Эти золи очень полезны в качестве калибровочных стандартов, а также в экспериментах для проверки новых гипотез. Они имеют и специальные применения в множительной технике, при получении антиотражательных покрытий линз и т.д. Вероятно, наиболее важным физическим свойством коллоидных дисперсных систем является тенденция частиц к агрегации. Коагуляция – это сильная агрегация, флокуляция – слабая, легко обратимая. Пептизация –процесс, в котором дисперсия восстанавливается (при слабом перемешивании или без него) при изменении состава дисперсионной среды, например при добавлении разбавленного раствора электролита. Устойчивость коллоидных систем – сложный вопрос. В простейшем случае она определяется балансом сил между вандерваальсовым притяжением и кулоновским отталкиванием частиц двойных слоев. (Эффекты ПАВ и полимерных добавок рассмотрены ниже.) Вандерваальсовы силы обычно проявляются как силы межмолекулярного притяжения, которые обусловливают переход газов в жидкое состояние. Энергия вандерваальсова взаимодействия двух атомов чрезвычайно мала и быстро уменьшается с увеличением расстояния между ними (примерно обратно пропорционально шестой степени расстояния). Если силы притяжения между всеми атомными парами в двух коллоидных частицах суммируются, значительно возрастает не только общее взаимодействие, но и дальнодействующие кулоновские силы отталкивания (обратно пропорционально, в степени 1–2, расстоянию между частицами). Коллоидные частицы, диспергированные в полярной жидкости, такой, как вода, обычно несут чистые (несвязанные) заряды на своей поверхности. Ионы дисперсионной среды, имеющие заряд, противоположный заряду частицы (противоионы), притягиваются к поверхности частицы, а ионы одинакового заряда (коионы) отталкиваются от нее (что не так существенно). Наложение этого эффекта на эффект перемешивания от теплового движения приводит к образованию двойного электрического слоя (ДЭС), образованного заряженной поверхностью частицы и избытком противоионов относительно коионов, распределенных диффузно в дисперсионной среде. Таким образом, частица может рассматриваться как окруженная диффузной ионной атмосферой с общим зарядом, равным ее заряду, но противоположного знака. В основном два параметра количественно определяют строение ДЭС: поверхностный потенциал (определяемый по измерению поверхностной плотности заряда) и эффективная толщина (определяемая измерением расстояния от поверхности, на котором существует влияние ДЭС). Поскольку поверхность частицы реально находится в области с резко изменяющимся ионным составом, определение (не говоря уже об измерении) поверхностного потенциала чрезвычайно затруднено. Однако частный случай определения поверхностного потенциала, так называемого дзета-потенциала, часто используется в исследованиях устойчивости коллоидных систем. Дзета-потенциал рассчитывается из результатов электрокинетических измерений, которые проще всего получить при исследовании электрофореза – движения заряженных частиц в электрическом поле. «Толщина» ДЭС зависит от концентрации электролита и валентности противоионов. Чем больше концентрация и валентность, тем меньше расстояние от поверхности частицы, на котором заряд частицы «экранируется» противоположным зарядом ДЭС со стороны дисперсионной среды. Если две коллоидные частицы сближаются, возникает энергия отталкивания вследствие взаимодействия одинаково заряженных частиц в диффузной части ДЭС вокруг них. Энергия отталкивания увеличивается с возрастанием дзета-потенциала (вначале быстро, а затем стремится к пределу при больших значениях дзета-потенциала) и уменьшается экспоненциально по мере возрастания отношения расстояния между частицами к толщине ДЭС. Общая энергия взаимодействия является суммой вандерваальсова притяжения и кулоновского отталкивания двойных слоев. Рассмотрим два крайних случая. При низких концентрациях электролита отталкивательное взаимодействие двойных слоев является дальнодействующим и (при условии, что дзета-потенциал является достаточно большим – обычно выше 25–30 мВ) определяет энергетический барьер коагуляции (подобно энергии активации в химической реакции). Скорость коагуляции соответственно будет замедляться и может сделаться такой малой, что золь можно считать практически стабильным. При высокой концентрации электролита отталкивание двойных слоев действует на малом расстоянии и на всех расстояниях между частицами превалирует вандерваальсово притяжение, так что энергетический барьер отсутствует и коагуляция происходит быстро. Переход между этими двумя крайними случаями можно осуществить путем добавления электролита; избыток электролита, необходимый для такого уменьшения потенциального барьера, при котором время коагуляции сократилось бы, например, от месяцев до минут, относительно мал. Отсюда можно измерить критическую концентрацию коагуляции; она зависит в основном от валентности противоионов. Лиофильные коллоиды. К лиофильным коллоидам относятся растворы
макромолекул, например желатин или крахмал в воде. Растворимости этих веществ
зависят от их сродства к молекулам растворителя и собственным молекулам.
Макромолекулы с высоким сродством к растворителю имеют достаточно открытую
конфигурацию и обладают высокой растворимостью, в то время как молекулы с б Устойчивость лиофобных золей можно часто повысить добавлением макромолекулярного материала, который адсорбируется на поверхности частиц. Такое адсорбирующееся вещество называется протектором или стабилизирующим агентом. Лучшими протекторами являются блок-сополимеры, которые имеют лиофобную часть (якорную группу), которая прочно связывает макромолекулу с поверхностью частицы, и лиофильный хвост, который свободно размещается в дисперсионной среде. Адсорбированная макромолекула может определять устойчивость золя благодаря своему влиянию на вандерваальсовы взаимодействия и взаимодействия двойных электрических слоев, но наиболее важна их роль, вероятно, в пространственной стабилизации частиц золя. В основном условия стабильности дисперсной системы будут теми же, что и для растворимости той части стабилизирующей макромолекулы, которая обращена в сторону дисперсионной среды. Если возникает агрегация частиц, то она будет ослабляться и становиться легко обратимой (флокуляция) благодаря адсорбированным макромолекулам протектора, которые способствуют разделению частиц. Равновесие между стабилизацией и флокуляцией очень подвижно и может меняться при изменении температуры. ПАВ также могут играть роль мощных стабилизаторов. Они обычно сильно адсорбируются на поверхности частиц и делают ее более лиофильной. Адсорбированные ионы ПАВ часто увеличивают электростатическую стабилизацию. Гидроксиды металлов, кремнезем и глины имеют высокое сродство к воде и могут существовать в форме гелей. Молекулы гидроксида алюминия после удаления молекул воды могут связываться в форме неорганических полимерных цепей, которые являются составными частями структуры геля. Частицы некоторых глин при подходящих условиях могут иметь отрицательно заряженные грани и положительно заряженные ребра, при этом притяжение грань – ребро делает легким образование структуры геля типа «карточного домика». В некоторых
случаях коллоидные дисперсные системы становятся более чувствительными к
агрегации при добавлении малых количеств макромолекулярных веществ или ПАВ,
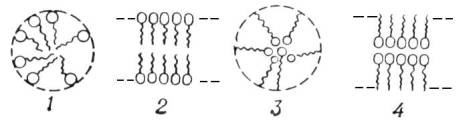
которые в б Агрегация частиц имеет важные следствия для седиментации и течения дисперсных систем. Если осаждающиеся частицы объединяются (склеиваются) друг с другом, объем осадка будет возрастать. Этот эффект важен, например, для улучшения плодородия почв (для аэрации) и качества красок. Результатом агрегации частиц является возрастание вязкости и возможность гелеобразования (желатинизации). Сдвиг (например, перемешивание) агрегированных дисперсных частиц способствует разрушению дисперсии. Если убрать усилие сдвига, агрегатная структура (и вязкость) в некоторых случаях медленно восстанавливается. Это свойство называется тиксотропией. Оно важно для процесса нанесения краски кистью, так как желательно, чтобы краска была текучей при нанесении на поверхность и короткое время после этого, чтобы можно было при необходимости выровнять мазок, но чтобы краска не подтекала. Эмульсии (новолат. emulsio, от лат. emulgeo — дою, выдаиваю; одной из первых изученных эмульсий было молоко), дисперсные системы, состоящие из мелких капель жидкости (дисперсной фазы), распределенных в другой жидкости (дисперсионной среде). Различают Э. прямые, типа «масло в воде», с каплями неполярной жидкости, например минерального масла, в полярной (обычно водной) среде, и обратные, типа «вода в масле», с каплями полярной жидкости в неполярной среде. Встречаются также «множественные» Э., в которых капли дисперсной фазы являются в то же время и дисперсной средой для более мелких капелек. Кроме того, Э. делят на лиофильные и лиофобные. Лиофильные Э., образующиеся самопроизвольно при температурах, близких к критической температуре смешения жидких фаз, термодинамически устойчивые обратимые системы. Лиофобные Э., возникающие при механическом, акустическом или электрическом диспергировании одной жидкости в другой либо вследствие выделения новой капельножидкой фазы из пересыщенных растворов или расплавов, термодинамически неустойчивы. Они могут длительно существовать только в присутствии эмульгаторов. Лиофильные Э. — высокодисперсные (коллоидные) системы, размер их капель не превышает 10-5 см. Лиофобные Э. — грубодисперсные системы (размер капель обычно лежит в пределах 10-5—10-2 см). При достаточно большой разнице в плотностях дисперсной фазы и дисперсионной среды они седиментационно (кинетически) неустойчивы. Седиментация капель Э., хорошо защищенных от коалесценции, приводит к концентрированию капель и образованию сливок или осадка без расслаивания Э. на две сплошные жидкие фазы. Тип и свойства Э. зависят от состава и соотношения жидких фаз, количества и химическая природы эмульгатора, способа и температуры эмульгирования и других факторов. Изменение состава Э. или внешнего воздействия могут вызвать так называемое обращение фаз — превращение прямой Э. в обратную или, наоборот, обратной в прямую. Низкоконцентрированные Э. с каплями, перемещающимися свободно и независимо друг от друга в легкоподвижной среде, — типичные жидкости. При повышении концентрации дисперсной фазы свыше 74% по объему (для Э. с одинаковым размером капель) вязкость системы резко возрастает, Э. желатинируются и приобретают свойства геля. При этом капли, имеющие первоначально сферическую форму, сильно деформируются и приобретают конфигурацию, близкую к многограннику. Содержание дисперсной фазы в высококонцентрированных Э. можно довести до 99% по объему; при этом дисперсионная среда сохранится между каплями лишь в виде тонких прослоек, подобных жидким пленкам между пузырьками в пенах. Разнообразные по составу и свойствам, Э. широко используют в промышленности, сельском хозяйстве, медицине, быту и других областях. Многокомпонентными Э. являются многие пищевые продукты (например, молоко, яичный желток), а кроме того, млечные соки растений, сырая нефть. В виде Э. применяют смазочно-охлаждающие жидкости, некоторые пестициды, косметические средства, лекарства, связующие для эмульсионных красок. В строительстве широко применяют битумные Э. Пены – дисперсии газов, т.е. дисперсные системы с газовой дисперсной фазой и жидкой или твердой дисперсионной средой. Пены в большинстве случаев получаются взбиванием жидкости либо насыщением жидкости газом под давлением с последующим снятием давления. Пены, подобно эмульсиям, термодинамически нестабильны, и для их стабилизации требуется наличие стабилизаторов, которые будут адсорбироваться на границе раздела газ/раствор. Хорошие эмульгаторы – в общем случае также хорошие стабилизаторы пен, поскольку факторы, которые влияют на стабильность эмульсии (исключающую коалесценцию) и на стабильность пен (сохраняющую пузырьки), аналогичны. Стабильность жидких пен зависит от способности жидких пленок стекать (с пузырьков) и утончаться без разрыва в результате случайных повреждений. Нестабильные пены типичны для водных растворов низкомолекулярных жирных кислот и спиртов. Присутствие этих слабых ПАВ сдерживает стекание жидкости, и процесс разрыва пленки замедляется, но не прекращается полностью и пузырьки в конечном счете лопаются. Метастабильные пены типичны для водных растворов мыл, детергентов, белков, сапонинов и др. Стекание жидкости происходит до момента достижения равновесия между вандерваальсовым притяжением в сочетании с капиллярными силами, способствующими утоньшению пленки, и отталкиванием двойных электрических слоев, которое противодействует им. Гибкий механизм саморегулирования в значительной степени защищает пленку от случайных повреждений; такие пены могут быть устойчивы в течение долгого времени. Действие пеногасителей обычно связано с заменой стабилизаторов на границе газ/раствор на соединение, не обеспечивающее стабильность пены. Аэрозоли (от аэро... и золи), системы, состоящие из твёрдых или жидких частиц, взвешенных в газообразной среде. По характеру образования различают диспергационные и конденсационные А. Диспергационные А. возникают: 1) при разбрызгивании жидкостей — таковы водяные туманы, образующиеся в водопадах, при морском прибое, в фонтанах и пр., А. из слизи, образующиеся при кашле и чихании, А. из инсектицидов, получаемые с помощью аэрозольных баллончиков; 2) при измельчении твёрдых тел и взмучивании порошков — например, пыль, поднимаемая с земли ветром, автомобильными колёсами, при подметании или образующаяся при пересыпании тонких порошков (муки, мела и пр.), в камнедробилках, при разрушении каменных стен, отбивании угля, шлифовании и т. д. Конденсационные А. появляются при конденсации паров — таковы природные облака, состоящие из водяных капелек или ледяных кристалликов, возникающих при конденсации водяного пара атмосферы, и близкие к облакам наземные туманы. При выплавке металлов пары их сгорают, а продукты горения конденсируются с образованием дыма, состоящего из твёрдых частиц металлических окислов. Примерно так же образуется дым и при горении топлива (в печах, автомобильных моторах), табака, пороха и различных органических веществ, но в этом случае, помимо твёрдых частиц сажи, в дыме содержатся ещё капельки смолистых веществ. Свойства А. определяются природой вещества, из которого состоят частицы, природой газовой среды, а также концентрацией А. по массе (т. е. общей массой частиц, содержащихся в единице объёма А.), и счётной концентрацией (числом частиц в единице объёма), размером, формой и зарядом частиц. Все эти величины могут иметь самые различные значения. Так, в безветренную ясную погоду за городом в 1 л воздуха содержится несколько десятков тысяч частиц с общей массой меньше 10-4 мг, а в шахте вблизи работающего угольного комбайна — миллиарды частиц с массой до нескольких десятков мг. Только с поверхности морей и океанов в атмосферу ежегодно поднимается в виде А. около 1010 т соли. Размер частиц в А. колеблется примерно от 1 нм до долей мм, например, размеры капелек облаков 5—50 мкм, частиц табачного дыма — десятые доли мкм, в пыли содержатся обычно частицы весьма различных размеров. Частицы диспергационных А. имеют довольно большие электрические заряды, как положительные, так и отрицательные. В конденсационных А., образовавшихся при не очень высокой температуре, частицы не заряжены, но постепенно приобретают небольшие заряды, захватывая лёгкие ионы, всегда присутствующие в газах. Важнейшие процессы, происходящие в А., — седиментация, броуновское движение, коагуляция и испарение частиц. Скорость седиментации (оседания под действием силы тяжести) пропорциональна приблизительно квадрату размера частиц и составляет нескольких десятков см/сек для частиц размером 100 мкм, нескольких мм/сек для частиц в 10 мкм и чрезвычайно мала для частиц меньше 1 мкм. Броуновское движение частиц тем интенсивнее, чем они мельче, и делается заметным лишь в случае частиц меньше 1 мкм. Под действием броуновского движения частицы осаждаются на любых поверхностях, с которыми А. соприкасаются, под действием же седиментации — лишь на обращенных кверху поверхностях, и на них поэтому всегда гораздо больше пыли, чем на вертикальных стенках. Коагуляция А. происходит при столкновениях между частицами под действием броуновского движения, неодинаковой скорости седиментации частиц разной величины, нагоняющих друг друга, под влиянием электрических сил и пр. Твёрдые частицы слипаются при столкновениях, а жидкие сливаются, и число «свободных» частиц уменьшается. Скорость коагуляции, т. е. уменьшение числа частиц в единицу времени, пропорциональна квадрату их концентрации. Поэтому при концентрации 1010 в см3 она уменьшается вдвое за 0,7 сек, а при концентрации 106 в см3 — за 12 мин. Испарение частиц наблюдается в А. из летучих веществ, например при «таянии» облаков. Все эти процессы приводят к разрушению А., однако обычно одновременно происходит образование новых частиц упомянутыми выше путями. Важнейшие оптические свойства А. — рассеяние и поглощение ими света. При пропускании светового пучка через А. (например, лучей прожектора через атмосферу ночью или солнечных лучей через щель в затемнённую комнату) наблюдается светящийся конус Тиндаля, тем более яркий, чем выше концентрация и размер частиц. Отдельные рассеивающие свет частицы удобно наблюдать с помощью ультрамикроскопа, однако рассеяние света быстро падает с уменьшением размера частиц и таким путём можно видеть лишь частицы больше 0,1 мкм. Тонкие А. рассеивают преимущественно короткие световые волны и кажутся поэтому голубоватыми, например дым, выходящий из горящего конца сигарет. А. играют большую положительную роль в жизни человека. Облака — важнейшее звено в круговороте воды в природе; поглощая солнечные лучи и тепловое излучение Земли, они умеряют и жару, и холод. Опыление многих растений, в том числе злаков, осуществляется А. из цветочной пыльцы. Всё жидкое и почти всё твёрдое топливо сжигается ныне в виде А. Борьба с вредителями и болезнями культурных растений и лесов ведётся с помощью А. из ядохимикатов. Многие важные технические материалы, например сажу, получают в виде А. Большое значение приобретает аэрозольтерапия и аэрозольная иммунизация людей и домашних животных. А. успешно применяют для борьбы с градобитием. Вместе с тем некоторые А. приносят большой вред. Огромную опасность представляют радиоактивные А., образующиеся при атомных взрывах, при добыче и переработке расщепляющихся материалов. Пыль, содержащая кремнезём, вызывает тяжёлое заболевание лёгких — силикоз, не менее опасна бериллиевая, свинцовая, хромовая пыль. Поэтому борьба с производственной пылью — одна из важнейших задач промышленной гигиены. Бактериальные А., содержащие болезнетворные микроорганизмы и образующиеся при кашле и чихании больных, могут служить источником инфекц. болезней, в том числе гриппа. Природные туманы препятствуют посадке самолётов. Пыльные бури — настоящее бедствие для жарких, сухих безлесных местностей. Борьба с аэрозольным загрязнением атмосферы в промышленных центрах — одна из важных проблем. А., содержащиеся в атмосфере, часто называют атмосферными аэрозолями. Мицеллы (новолат. micella, уменьшительное от лат. mica — крошка, крупинка), отдельная частица дисперсной фазы золя, т. е. высокодисперсной коллоидной системы с жидкой дисперсионной средой. М. состоит из ядра кристаллической или аморфной структуры и поверхностного слоя, включающего сольватно связанные (см. Сольватация) молекулы окружающей жидкости. Поверхностный слой М. лиофобного золя (см. Лиофильные и лиофобные коллоиды) образован адсорбированными молекулами или ионами стабилизирующего вещества. В случае лиофобных гидрозолей, стабилизованных электролитами, ядро М. окружено двумя слоями противоположно заряженных ионов, т. н. двойным электрическим слоем. Число положительных и отрицательных зарядов в нём одинаково, и поэтому М. в целом электронейтральна. Непосредственно у поверхности ядра расположены ионы адсорбционного слоя. В него входят все ионы одного знака и часть ионов другого знака (противоионы). Остальные противоионы образуют диффузный слой; он окружает М. в виде ионного «облака», плотность которого падает по мере удаления от ядра. Диффузный слой препятствует сближению и агрегированию (сцеплению) частиц в процессе броуновского движения. В лиофильных золях, коллоидных дисперсиях типа гидрозолей мыл, например олеата натрия или лаурилсульфата калия, М. представляет собой ассоциат (объединение) молекул. В каждой такой молекуле длинный углеводородный (гидрофобный) радикал связан с полярной (гидрофильной) группой. При образовании М. несколько десятков или сотен молекул объединяются так, что гидрофобные радикалы образуют ядро (внутреннюю область), а гидрофильные группы — поверхностный слой М. Если дисперсионной средой является органическая жидкость, ориентация молекул в М. может быть обратной: в ядре сосредоточатся полярные группы, тогда как гидрофобные радикалы будут обращены во внешнюю фазу. Изобразив молекулу мицеллообразующего вещества в виде волнистой линии (гидрофобный радикал) с кружочком на конце (гидрофильная группа), можно представить простейшие структурные типы М. схемами:
Гели (от лат. gelo — застываю), дисперсные системы с жидкой или газообразной дисперсионной средой, обладающие некоторыми свойствами твёрдых тел: способностью сохранять форму, прочностью, упругостью, пластичностью. Эти свойства Г. обусловлены существованием у них структурной сетки (каркаса), образованной частицами дисперсной фазы, которые связаны между собой молекулярными силами различной природы Типичные Г. в виде студенистых осадков (коагелей) образуются из золей при их коагуляции или в процессах выделения новой фазы из пересыщенных растворов как низко-, так и высокомолекулярных веществ. Г. с водной дисперсионной средой называют гидрогелями, с жидкой углеводородной средой — органогелями. Отверждение золей во всём объёме без выделения осадка и нарушения их однородности даёт т. н. лиогели. Вся дисперсионная среда в таких Г. лишена подвижности (иммобилизована) вследствие механического захватывания в ячейках структурной сетки. Чем больше асимметрия частиц, тем при более низком содержании дисперсной фазы образуется гель. В случае гидрозоля пятиокиси ванадия, например, для отверждения системы достаточно 0,05%, в др. случаях — нескольких объёмных процентов дисперсной фазы. Лиогели обладают малой прочностью, пластичностью, некоторой эластичностью и тиксотропией, т. е. способностью обратимо восстанавливать структуру, разрушенную механическим воздействием. Таковы, например, Г. мыл и мылоподобных поверхностно-активных веществ, Г. гидроокисей многих поливалентных металлов. Высушиванием лиогелей можно получить аэрогели, или ксерогели, — микропористые системы, лишённые пластичности, имеющие хрупкую, необратимо разрушаемую структуру. Так получают распространённые сорбенты: алюмогель из Г. гидроокиси алюминия и силикагель из студней кремнёвой кислоты. Страницы: 1, 2 |
|
||||||||||||||||||||||||||||||||||||||||